নে-সিএল এবং নে-ব্র এর মধ্যে কোনটির গলনাঙ্ক বেশি? আয়নিক যৌগে গলনাঙ্ক কী নির্ধারণ করে?
আমি হলুদ সোডিয়ামের দুটি গুরুত্বপূর্ণ লবণ, সোডিয়াম ক্লোরাইড এবং সোডিয়াম ব্রোমাইডের গলনাঙ্ক নিয়ে আলোচনা করব। আমরা জানব গলনাঙ্ক কী, আয়নিক যৌগে গলনাঙ্ক নির্ধারণকারী কারণগুলি কী কী এবং NaCl এবং NaBr এর গঠন এবং বন্ধনগুলি কীভাবে তাদের গলনাঙ্ককে প্রভাবিত করে। আমরা এই দুটি লবণের গলনাঙ্কের তুলনা করব এবং নির্ধারণ করব কোনটির গলনাঙ্ক বেশি। এই আলোচনা থেকে আমরা এই আয়নিক যৌগগুলির পদার্থবিদ্যার একটি গভীর বোধগম্যতা অর্জন করব।
সোডিয়াম ক্লোরাইড ও সোডিয়াম ব্রোমাইড: গলনাংক তুলনা
নমস্কার, আমরা সবাই জানি যে সোডিয়াম ক্লোরাইড, যা সাধারণ নুন হিসাবে পরিচিত, এবং সোডিয়াম ব্রোমাইড উভয়ই আয়নিক যৌগ। কিন্তু তাদের গলনাংকে একটি উল্লেখযোগ্য পার্থক্য রয়েছে। এই ব্লগ পোস্টে, আমরা সোডিয়াম ক্লোরাইড এবং সোডিয়াম ব্রোমাইডের গলনাংক তুলনা করব এবং তাদের মধ্যে পার্থক্যের কারণগুলি অন্বেষণ করব।
সোডিয়াম ক্লোরাইডের গলনাংক 801° সেলসিয়াস, অন্যদিকে সোডিয়াম ব্রোমাইডের গলনাংক 747° সেলসিয়াস। এর অর্থ হল সোডিয়াম ক্লোরাইড সোডিয়াম ব্রোমাইডের চেয়ে বেশি তাপমাত্রার প্রয়োজন গলানোর জন্য। এই পার্থক্যটি বেশ কয়েকটি কারণের কারণে ঘটে, যার মধ্যে একটি হল সোডিয়াম এবং ক্লোরিন আয়নগুলির মধ্যে বন্ধনের প্রকৃতি।
সোডিয়াম ক্লোরাইডে, সোডিয়াম এবং ক্লোরিন আয়নগুলির মধ্যে আন্তঃক্রিয়া তুলনামূলকভাবে দুর্বল, কারণ তাদের আকার এবং চার্জ খুব বেশি পৃথক নয়। এর ফলে একটি ক্রিস্টাল গঠন তৈরি হয় যেখানে আয়নগুলি তুলনামূলকভাবে দূরত্বে স্থাপন করা হয় এবং অপেক্ষাকৃত কম শক্তির দ্বারা একসাথে বদ্ধ থাকে। এই দুর্বল বন্ধনগুলি সহজে ভেঙে যেতে পারে, যা সোডিয়াম ক্লোরাইডের তুলনামূলকভাবে কম গলনাংকের জন্য দায়ী।
বিপরীতে, সোডিয়াম ব্রোমাইডে, সোডিয়াম এবং ব্রোমিন আয়নগুলির মধ্যে আন্তঃক্রিয়া অনেক শক্তিশালী, কারণ ব্রোমিন আয়নগুলি ক্লোরিন আয়নগুলির চেয়ে অনেক বড় এবং বেশি চার্জযুক্ত। এর ফলে একটি ক্রিস্টাল গঠন তৈরি হয় যেখানে আয়নগুলি আরও ঘনিষ্ঠভাবে সজ্জিত থাকে এবং একটি শক্তিশালী আকর্ষণ দ্বারা একত্রে আবদ্ধ থাকে। এই শক্তিশালী বন্ধনগুলি ভাঙতে বেশি শক্তির প্রয়োজন হয়, যা সোডিয়াম ব্রোমাইডের তুলনামূলকভাবে উচ্চ গলনাংকের জন্য দায়ী।
গলনাঙ্ক কী?
গলনাঙ্ক হল সেই নির্দিষ্ট তাপমাত্রা যাতে একটি পদার্থ তার কঠিন অবস্থা থেকে তরল অবস্থায় রূপান্তরিত হয়। যখন একটি পদার্থের গলনাঙ্কের তাপমাত্রায় পৌঁছায়, তখন তার কণার মধ্যে পর্যাপ্ত শক্তি থাকে পারস্পরিক আকর্ষণ কাটিয়ে উঠতে এবং স্বাধীনভাবে চলাফেরা করতে। ফলে, পদার্থটি তার নির্দিষ্ট আকার এবং আয়তন হারিয়ে প্রবাহিত হতে সক্ষম হয়। বিভিন্ন পদার্থের গলনাঙ্কের তাপমাত্রা ভিন্ন হয়, যা তাদের আণবিক গঠন এবং আণবিক ভরের উপর নির্ভর করে।
আয়নিক যৌগে গলনাঙ্ক নির্ধারণকারী কারণ
আমরা সবাই জানি যে আয়নিক যৌগ তাদের উচ্চ গলনাঙ্কের জন্য পরিচিত। কিন্তু তুমি কি জানো কেন? আজ আমি তোমাদের সাথে আয়নিক যৌগের গলনাঙ্ক নির্ধারণকারী কারণগুলো সম্পর্কে আলোচনা করবো।
একটি আয়নিক যৌগের গলনাঙ্ক মূলত তিনটি কারণের উপর নির্ভর করে:
১। আয়নগুলির আকার: আয়ন যত বড় হবে, তত কম শক্তিশালী আয়ন-আয়ন আকর্ষণ হবে এবং ততই কম হবে গলনাঙ্ক।
২। আয়নগুলির চার্জ: আয়নগুলির চার্জ যত বেশি হবে, তত বেশি শক্তিশালী হবে আয়ন-আয়ন আকর্ষণ এবং ততই বেশি হবে গলনাঙ্ক।
৩। স্ফটিকের জ্যামিতি: আয়নগুলি যেভাবে সজ্জিত থাকে তা স্ফটিকের জ্যামিতি নির্ধারণ করে। কম সংহত স্ফটিকের জ্যামিতির কারণে আয়নগুলির মধ্যে আকর্ষণ কমে যায় এবং তাই গলনাঙ্ক কমে যায়।
উদাহরণস্বরূপ, NaCl এবং NaBr দুটি আয়নিক যৌগ। NaCl-এ Na+ এবং Cl- আয়নগুলি ছোট এবং উচ্চ চার্জযুক্ত, যা একটি উচ্চ গলনাঙ্কের দিকে পরিচালিত করে। অন্যদিকে, NaBr-এ Br- আয়ন Cl- আয়নের চেয়ে বড়, যা একটি কম গলনাঙ্কের দিকে পরিচালিত করে।
NaCl ও NaBr-এর গঠন ও বন্ধন
NaCl ও NaBr উভয়ই আয়নিক যৌগ, যা ধনাত্মক ও ঋণাত্মক আয়ন দ্বারা গঠিত হয়। এগুলির গঠন এবং বন্ধন প্রক্রিয়া নিম্নরূপ:
এখানে NaCl এর গঠন ও বন্ধন:
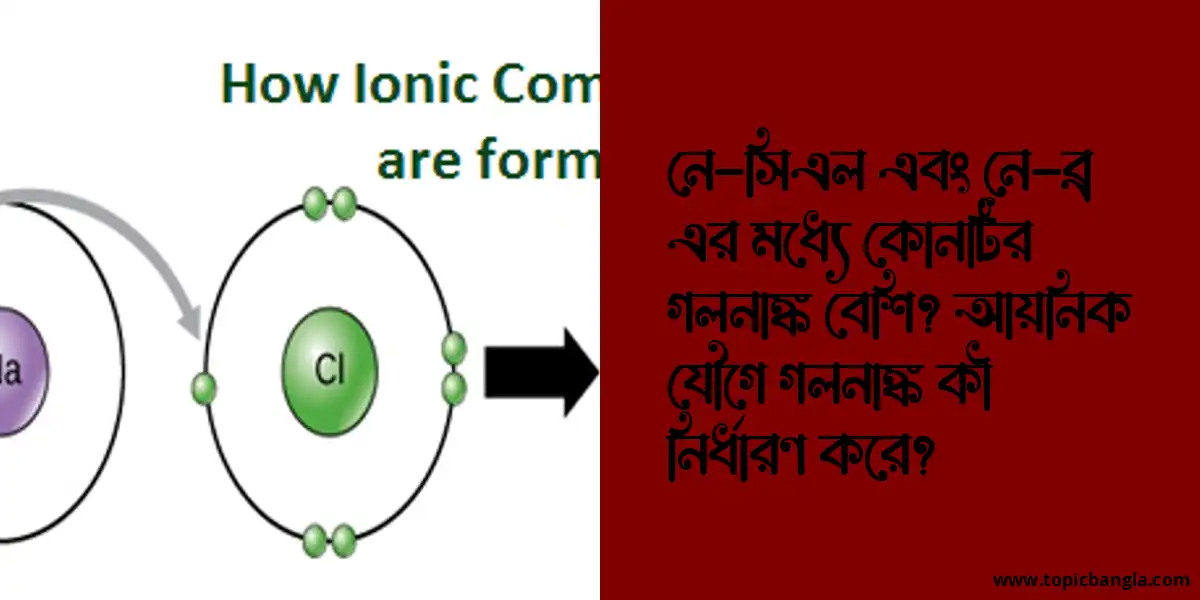
NaCl সাধারণ লবণ হিসেবে পরিচিত যা সোডিয়াম (Na+) এবং ক্লোরিন (Cl-) আয়ন দ্বারা গঠিত। এখানে, সোডিয়াম একটি ধনাত্মক আয়ন যা তার একমাত্র বহিরাগত ইলেকট্রন হারিয়েছে, যখন ক্লোরিন একটি ঋণাত্মক আয়ন যা তার একটি বহিরাগত ইলেকট্রন লাভ করেছে। এই ধনাত্মক এবং ঋণাত্মক আয়নগুলি শক্তিশালী ইলেক্ট্রোস্ট্যাটিক আকর্ষণের মাধ্যমে একত্রে আবদ্ধ থাকে, যা আয়নিক বন্ধন তৈরি করে।
NaBr এর গঠন ও বন্ধন:
NaBr সোডিয়াম ব্রোমাইড নামে পরিচিত যা সোডিয়াম (Na+) এবং ব্রোমিন (Br-) আয়ন দ্বারা গঠিত। এখানেও, সোডিয়াম একটি ধনাত্মক আয়ন এবং ব্রোমিন একটি ঋণাত্মক আয়ন। তবে, NaBr এর ক্ষেত্রে, ব্রোমিন আয়নের আকার ক্লোরিন আয়নের চেয়ে বড়। এর ফলে, NaBr এর আয়নিক বন্ধন NaCl এর চেয়ে দুর্বল হয় কারণ দুটি আয়নের মধ্যে বৃহত্তর দূরত্ব ইলেক্ট্রোস্ট্যাটিক আকর্ষণকে হ্রাস করে।
গলনাঙ্ক তুলনা:
আয়নিক বন্ধনের শক্তির কারণে আয়নিক যৌগগুলি সাধারণত উচ্চ গলনাঙ্ক থাকে। NaCl এর গলনাঙ্ক 801°C, যখন NaBr এর গলনাঙ্ক 755°C। NaBr এর ক্ষেত্রে এর বৃহত্তর আয়নিক আকারের কারণে আয়নিক বন্ধন দুর্বল হওয়ার কারণে NaCl এর চেয়ে গলনাঙ্ক কম। ফলস্বরূপ, আমরা বলতে পারি যে NaCl এর গলনাঙ্ক NaBr এর চেয়ে বেশি।
গলনাঙ্ক তুলনা
আইনিক যৌগের গলনাঙ্কের তুলনায়, NaCl এবং NaBr এর জন্য:
মূলত NaCl এবং NaBr উভয় আইনিক যৌগ, কিন্তু তাদের ভিন্ন গলনাঙ্ক রয়েছে। গলনাঙ্ক হল একটি পদার্থের সেই তাপমাত্রা যেখানে পদার্থ তার সলিড অবস্থা থেকে তরল অবস্থায় পরিবর্তিত হয়। NaCl এর গলনাঙ্ক 801 °C, এবং NaBr এর গলনাঙ্ক 755 °C। এর অর্থ এই যে NaCl, NaBr এর চেয়ে বেশি তাপমাত্রায় গলে যায়।
NaCl এবং NaBr এর গলনাঙ্কের পার্থক্য তাদের আয়নিক বন্ডের শক্তির পার্থক্যের কারণে। আয়নিক বন্ড হল দুটি বিপরীত চার্জযুক্ত আয়নগুলির মধ্যে বৈদ্যুতিক আকর্ষণ। Na+ এবং Cl- আয়নগুলির মধ্যে আয়নিক বন্ড, Na+ এবং Br- আয়নগুলির মধ্যে আয়নিক বন্ডের চেয়ে শক্তিশালী। এর কারণ হল Cl- আয়ন Br- আয়ন অপেক্ষা ছোট। ছোট আয়নগুলির আধানগুলি ঘনিষ্ঠভাবে সংকুচিত হয়, যা শক্তিশালী আয়নিক বন্ডের দিকে পরিচালিত করে।
NaCl এবং NaBr এর গলনাঙ্কের পার্থক্যের জানা অনেক ব্যবহারিক প্রয়োগ রয়েছে। উদাহরণস্বরূপ, NaCl রাস্তায় বরফ গলাতে ব্যবহৃত হয়, কারণ এর উচ্চ গলনাঙ্ক এটিকে তাপে গলতে বাধা দেয়। NaBr, অন্যদিকে, আলোকচিত্র এবং তাপ সংবেদনশীল সিস্টেমগুলিতে ব্যবহৃত হয়, কারণ এর নিম্ন গলনাঙ্ক এটিকে কক্ষ তাপমাত্রায় তরল হিসাবে থাকতে দেয়।
উপসংহার
আমাদের আলোচনা থেকে এটি স্পষ্ট যে NaCl এবং NaBr উভয়ই আয়নিক যৌগ। যাইহোক, তাদের গলনাঙ্কের মধ্যে উল্লেখযোগ্য পার্থক্য রয়েছে। NaCl এর গলনাঙ্ক 801 ডিগ্রি সেলসিয়াস, যেখানে NaBr এর গলনাঙ্ক 747 ডিগ্রি সেলসিয়াস। এই পার্থক্যটি Cl- এবং Br- আয়নগুলির আকারের পার্থক্যের কারণে। Cl- আয়ন Br- আয়নগুলির চেয়ে ছোট, যার ফলে NaCl এর আয়নগুলি আরও শক্তভাবে বন্ধ হয়ে যায়। এই শক্ত বন্ধন NaCl এর উচ্চ গলনাঙ্কের কারণ।
অতএব, আমাদের পর্যবেক্ষণ থেকে আমরা আসতে পারি যে NaCl এর গলনাঙ্ক NaBr এর চেয়ে বেশি। এটি Cl- এবং Br- আয়নগুলির আকারের পার্থক্যের কারণে।